1. Ba là gì trong hóa học?
Ba trong hoá học thường là ký hiệu hoá học cho kim loại Barium (Ba) – Đây là một hợp chất tồn tại ở dạng tinh thể trắng, có thể hòa tan trong nước, có độc tính mạnh và không có mùi.
Hóa chất Ba không được tìm thấy trong tự nhiên dưới dạng nguyên tố tự do vì Ba có phản ứng hóa học cực kỳ cao. Bari sunfat và Bari cacbonat là hai khoáng vật phổ biến nhất của Ba ở trong tự nhiên.
2. Lịch sử ra đời của Ba (Barium)?
Được phát hiện vào năm 1808 bởi Humphry Davy và Jöns Jacob Berzelius, Barium là một trong những nguyên tố được phát hiện trong quá trình nghiên cứu các khoáng vật.
Ban đầu, Barium không được cô lập dưới dạng nguyên tố, mà là dưới dạng hợp chất từ khoáng vật barite (BaSO₄), một dạng sulfate của Barium. Davy và Berzelius đã tiến hành phản ứng điện hóa trên barite để giải phóng Barium từ hợp chất này.
2. Tính chất của Ba trong hoá học?
Tính chất vật lý:
– Bari là kim loại kiềm thổ màu trắng bạc, dẻo, rèn được. Bị phủ màng oxit – nitrua thẩm trong không khí ẩm.
– Có khối lượng riêng là 3,6 g/cm3; có nhiệt độ nóng chảy là 7270C và sôi ở 18600C.
Tính chất hoá học:
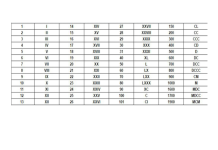
– Kí hiệu: Ba
– Cấu hình electron: [Xe] 6s1
– Số hiệu nguyên tử: 56
– Khối lượng nguyên tử: 137 g/mol
– Vị trí trong bảng tuần hoàn
- Ô: số 56
- Nhóm: IIA
- Chu kì: 6
– Đồng vị: 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba
– Độ âm điện: 0,89
– Bari là kim loại kiềm thổ có tính khử mạnh: Ba → Ba2+ + 2e
– Tác dụng với phi kim (oxi, halogen….)
2Ba + O2 → 2BaO
Ba + Cl2 →BaCl2
– Tác dụng với axit:
– Với dung dịch axit HCl:
Ba + 2HCl → BaCl2 + H2
– Với dung dịch HNO3:
Ba + 4HNO3 đặc → Ba(NO3)2 + 2NO2 + 2H2O.
Lưu ý: Kim loại Ba dễ dàng phản ứng với hầu hết axit, với ngoại lệ là axit sunfuric, phản ứng dừng lại khi tạo thành lớp muối không tan trên bề mặt là bari sulfat.
– Tác dụng với nước: Ở nhiệt độ thường, Ba khử nước mãnh liệt.
Ba + 2H2O → Ba(OH)2 + H2
3. Ứng dụng của Ba?
– Sản xuất thuỷ tinh: Barium carbonate (BaCO₃) được sử dụng làm chất đệm trong quá trình sản xuất thủy tinh, giúp tăng cường độ trong, độ trong suốt và độ cứng của thủy tinh
– Sản xuất sơn và chất phủ: Barium sulfate (BaSO₄), còn được gọi là baryte, được sử dụng làm chất màu trắng trong sơn, chất phủ và mực in để tăng độ phủ và độ trắng.
– Sản xuất thuốc nổ: Một số hợp chất Barium, như nitrat Barium (Ba(NO₃)₂), được sử dụng trong công nghiệp thuốc nổ như là một phụ gia để tăng cường hiệu suất của thuốc nổ.
– Sản xuất hợp kim: Barium có thể được sử dụng như một thành phần trong việc sản xuất các loại hợp kim, như hợp kim Ba-Ni (Barium-Nickel) và hợp kim Ba-Cu (Barium-Copper).
4. Kết luận:
OK trên đây là bài viết của mình về Ba là gì trong hóa học? Tính chất hoá học của Ba – chúc các bạn có các kiến thức thú vị.