A/ Lý thuyết bài: Nồng độ dung dịch
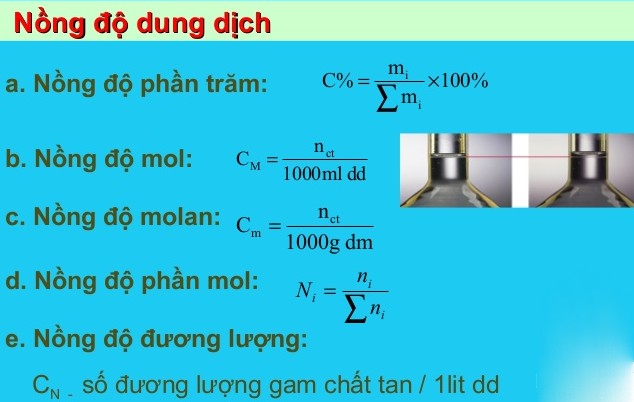
1. Nồng độ phần trăm
Nồng độ phần trăm (kí hiệu C%) của một dung dịch cho ta biết số gam chất tan trong 100g dung dịch
CT:
C% = mct/cdd.100%
Trong đó:
- mct là khối lượng chất tan, tính bằng gam
- mdd là khối lượng dung dich, tính bằng gam
- khối lượng dung dịch = khối lượng chất tan + khối lượng dung môi
2. Nồng độ mol dung dich
Nồng độ mol (kí hiệu CM) của dung dịch cho biết số mol chất tan trong 1 lit dung dịch
![]()
Trong đó:
- n : số mol chất tan
- V: thể tích dung dịch (lít)
B/ Trắc nghiệm bài: Nồng độ dung dịch
Câu 1: Số mol trong 400 ml NaOH 6M là
A. 1,2 mol B. 2,4 mol C. 1,5 mol D. 4 mol
Câu 2: Hòa tan 300 ml Ba(OH)2 0,4M. Tính khối lượng cuả Ba(OH)2
A. 20,52 gam B. 2,052 gam C. 4,75 gam D. 9,474 gam
Câu 3: Hòa tan CuSO4 40% trong 90 g dung dịch. Số mol cần tìm là
A. 0,225 mol B. 0,22 mol C. 0,25 mol D. 0,252 mol
Câu 4: Tính nồng độ mol của 456 ml Na2CO3 10,6 gam
A. 0,32 M B. 0,129 M C. 0,2 M D. 0,219 M
Câu 5: Dung dich HCl 25% (D = 1,198 g/ml). Tính CM
A. 8M B. 8,2M C. 7,9M D. 6,5M
Câu 6: Dung dich NaOH 4M (D = 1,43 g/ml). Tính C%
A. 11% B. 12,2% C. 11,19% D. 11,179%
Câu 7: Hòa tan 40 g đường với nước được dung dịch đường 20%. Tính khối lượng dung dịch đường thu được
A. 150 gam B. 170 gam C. 200 gam D. 250 gam
Câu 8: Hòa tan 50 g đường với nước được dung dịch đường 10%. Tính khối lượng nước cần chop ha chế dung dịch
A. 250 gam B. 450 gam C. 50 gam D. 500 gam
Đáp án:
| 1.B | 2.A | 3.A | 4.D | 5.B |
| 6.C | 7.C | 8.B |
Hướng dẫn:
Câu 1: Hướng dẫn giải: n = CM.V = 0,6.4 = 2,4 (mol)
Câu 2: Hướng dẫn giải:
+ nBa(OH)2 = 0,4.0,3 = 0,12 mol
+ mBa(OH)2 = 0,12.171 = 20,52 g
Nồng độ phần trăm, nồng độ mol của 1 dung dịch là gì? Bài viết dưới đây sẽ giúp chúng ta hiểu được khái niệm, ý nghĩa của nồng độ phần trăm, nồng độ mol, biết vận dụng công thức tính nồng độ phần trăm, nồng độ mol của dung dịch và những đại lượng liên quan đến dung dịch để làm các bài tập.
NỒNG ĐỘ DUNG DỊCH
I/ Nồng độ phần trăm: (C%)
Nồng độ phần trăm của dd cho biết số gam chất tan có trong 100 gam dd
– Khối lượng chất tan là mct
– Khối lượng dd là mdd
– Nồng độ phần trăm là C%
=> C%= (mct.100):mdd
Ví dụ 1: Hoà tan 10 gam đường vào 40 gam nước. Tính nồng độ phần trăm của dd thu được.
Giải:
mdd = mdm + mct = 40+10=50 gam
C% = (mct.100): mdd
= (10.100) : 50
= 20%
Ví dụ 2: Tính khối lượng NaOH có trong 200 gam dd NaOH 15%
Giải:
mNaOH = (C%.mdd):100
=15.200:100
=30 gam
Ví dụ 3: Hoà tan 20 gam muối vào nước được dd có nồng độ 10%
a) Tính khối lượng dd nước muối thu được
b) Tính khối lượng nước cần dựng cho sự pha chế
Giải:
a) mdd=(mmuối.100):C%
=20.100:10
=200 gam
b) mnước=mdd-mmuối
=200-20
=180 gam
II. Nồng độ mol của dd
Nồng độ mol của dd cho biết số mol chất tan cú trong một lit dd
CM=n:Vdd
Trong đó:
CM là nồng độ mol
n là số mol chất tan
Vdd là thể tích dd (lit)
Ví dụ 1: Trong 200 ml dd có hoà tan 16 gam NaOH. Tính nồng độ mol của dd.
Giải:
Đổi: 200ml=0,2lit
nNaOH=16:40=0,4 mol
CM=n:V=0,4:0,2=2M
Ví dụ 2:
Tính khối lượng H2SO4 có trong 50ml dd H2SO4 2M
Giải:
Tính số mol H2SO4 có trong dd H2SO4 2M
= CM.V=2.0,05 =0,1mol
= n.M=0,1.98=9,8 gam
III. Bài tập vận dụng
Bài tập 1:
Trộn 50 gam dd muối ăn có nồng độ 20% với 50 gam dd muối ăn 5%. Tính nồng độ phần trăm của dd thu được?
Bài tập 2: Để hoà tan m gam kẽm cần vừa đủ 50 gam dd HCl 7,3%
a) Viết PTPƯ
b) Tính m?
c) Tính thể tích khí thu được (ở đktc)
d) Tính khối lượng muối tạo thành sau phản ứng
Bài tập 3:
Hoà tan 6,5 gam kẽm cần vừa đủ Vml dd HCl 2M
a) Viết ptpư
b) Tính V
c) Tính thể tích khí thu được (ở đktc)
d) Tính khối lượng muối tạo thành sau p/ư
Bài 4: Trộn 2,5 lit dd đường 0,5M với 3 lit dd đường 1M. Tính nồng độ mol của dd sau khi trộn
Bài 5: Để hòa tan hết m (g) kẽm cần dùng vừa đủ 50g dung dịch HCl 7,3%.
a. Viết phương trình phản ứng xảy ra.
b. Tính thể tích H2 thu được (đktc).
c. Xác định giá trị m.
IV. Đáp án
Bài 1:
– Tính khối lượng chất tan trong dd 1
mmuối (1)= (C%*mdd):100=(20*50):100=10 gam
– Tính khối lượng chất tan trong dd 2
mmuối (2)= (C%*mdd):100=(5*50):100=2,5 gam
– Tính khối lượng chất tan trong dd 3
mmuối (3)= mmuối (1) + mmuối (2)=10+2,5=12,5 gam
– Tính khối lượng dd 3
mdd (3)= mdd(1) + mdd (2)= 50+50=100 gam
– Tính nồng độ phần trăm của dd 3:
C%(3)=(mct(3)*100):mdd(3)
=12,5 %
Bài 2:
Bài giải:
Zn + 2HCl—> ZnCl2 + H2
mHCl=(C%.mdd):100
=(50.7,3):100
=3,65 gam
=> nHCl= 3,65:36,5
=0,1 mol
Theo PTPƯ:
nZn=nZnCl2=nH2=1/2.nHCl=0,1:2=0,05 mol
b) m = mZn= 0,05.65 = 3,25 gam
c) VH2 = 0,05.22,4 = 1,12 lit
d) mZnCl2 = 0,05.136= 6,8 gam
Bài 3:
Zn+2HClà ZnCl2 +H2
nZn= 6,5:65=0,1 mol
b) Theo pthh
nHCl=2nZn=.0,1 =0,2 mol
à Vdd HCl=n:cM=0,2:2=0,1 lit =100 ml
c) Theo pthh
nH2=nZnCl2= nZn=0,1 mol
VH2=0,1 . 22,4 =2,24 lit
d) mZnCl2=0,1.136=13,6 gam
Bài 4:
– Tính số mol đường có trong dd 1:
n1=CM 1.Vdd 1=0,5.2=1 mol
– Tính số mol đường có trong dd 2:
n2=CM 2.Vdd 2 =1.3=3 mol
– Tính số mol đường có trong dd 3:
n3=n1+n2=1+3=4 mol
– Tính thể tích dd 3
Vdd 3=Vdd 1 +Vdd 2=2+3=5 lit
– Tính nồng độ mol dd 3
CM=n:V=4:5=0,8 M
Bài 5:
a. Zn + 2HCl à ZnCl2 + H2
1 mol 2 mol 1 mol
0,05mol 0,1mol 0,05mol
b. Ta có:
= = = 3,65 g
= = 0,1 mol
b. = 0,05.22,4 = 11,2 l
c. = 0,05.65 = 3,25 g