1. al là gì trong hóa học?
Al trong hóa học gọi là Nhôm (hay Aluminium hay Aluminum) là một nguyên tố hóa học trong bảng tuần hoàn nguyên tố có ký hiệu Al và số hiệu nguyên tử bằng 13.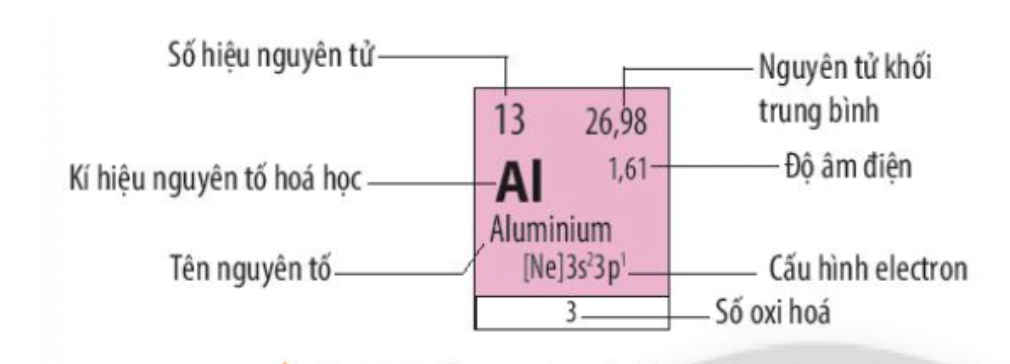
Cụ thể:
- Số hiệu nguyên tử: 13 => Số proton = số electron = số đơn vị điện tích hạt nhân = 13
- Nguyên tử khối trung bình = 27
- Độ âm điện = 1,61
- Kí hiệu hóa học: Al
- Tên nguyên tố: Aluminium
- Cấu hình electron => Al thuộc chu kì 3, nhóm IIIA
- Số oxi hóa của Al trong hợp chất
2. Tính chất hóa học của al?
- Kim loại nhẹ: Nhôm là một kim loại nhẹ, có mật độ thấp, làm cho nó trở thành một vật liệu lý tưởng trong các ứng dụng cần giảm trọng lượng, như trong ngành hàng không và công nghiệp vận tải.
- Tính bền và chống ăn mòn: Mặc dù nó mềm khi so sánh với một số kim loại khác, nhưng nhôm có độ bền và khả năng chống ăn mòn tốt, đặc biệt là do tạo một lớp oxide bền bên ngoài bảo vệ khỏi sự ăn mòn.
- Dẫn điện và dẫn nhiệt tốt: Nhôm là một tuyển tốt của nhiệt và điện, điều này làm cho nó được sử dụng rộng rãi trong sản xuất dây điện và các ứng dụng dẫn nhiệt.
- Tính linh hoạt và dễ gia công: Nhôm có thể được chế tạo thành nhiều hình dạng và kích thước khác nhau, điều này làm cho nó dễ dàng sử dụng trong nhiều ứng dụng khác nhau từ sản xuất ô tô đến đóng gói thực phẩm.
- Tương tác với oxit: Nhôm tương tác với oxit, tạo thành nhôm oxit (Al2O3), một chất rắn bền và chống ăn mòn. Nhôm oxit còn được sử dụng trong việc sản xuất nhôm.
- Khả năng tái chế cao: Nhôm có khả năng tái chế cao, giúp giảm lượng rác thải và tiêu tốn năng lượng ít hơn so với việc sản xuất từ nguyên tố nguyên thủy.
3. Tính chất vật lý của al?
– Nhôm là kim loại nhẹ (khối lượng riêng 2,7g/cm3).
– Màu trắng bạc, nóng chảy ở nhiệt độ không cao lắm (660oC).
– Nhôm mềm, dễ kéo sợi và dễ dát mỏng.
– Nhôm dẫn điện và dẫn nhiệt tốt.
* Nhận biết
Cho Al phản ứng với dung dịch NaOH (hoặc KOH). Hiện tượng quan sát được: Nhôm tan dần, sinh ra khí không màu.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
4. Bài tập ví dụ:
Bài 2: Cho Dung dịch A chứa Al2(SO4)3, dung dịch B chứa KOH. Cho 150ml hoặc 600ml dung dịch B vào 200ml dung dịch A. Sau phản ứng hoàn toàn, lọc lấy kết tủa, nung đến khối lượng không đổi đều thu được 0,204 gam chất rắn. Nồng độ mol của dung dịch A là:
A. 0,0325.
B. 0,0650.
C. 0,0130.
D. 0,0800.
Đáp án A
Lời giải:
Gọi nồng độ mol của Al2(SO4)3 và KOH lần lượt là a và b
Trường hợp 1: 150ml dung dịch B vào 200ml dung dịch A, KOH hết, Al2(SO4)3 dư
nOH- = 3nAl(OH)3 = 6nAl2O3
5. Kết luận?
OK trên đây mình đã tổng hợp cho các bạn kiến thức về al là nguyên tố gì rồi – chúc các bạn có các kiến thức thú vị.






















[…] qua có vẻ rất giống al trong hóa học, tuy nhiên l trong hóa học lại là một kí hiệu của một nguyên tố khác. Ok hãy […]
[…] ở nhiệt độ thường và tính chất hóa học của nó hơi giống với nhôm (al). Nó có tính dẫn nhiệt rất tốt, không có từ tính được sử dụng chủ yếu […]
Comments are closed.